基金项目:国家自然科学基金(No.51972278)
作者简介:许洪鹏(1997-),男,硕士研究生。E-mail:1012233701@qq.com
通信作者:黄琪(1986-),男,博士。E-mail:huangqi_1986@163.com
彭汝芳(1967-),女,博士,博导,教授。E-mail:rfpeng2006@163.com
(1. 西南科技大学 环境友好能源材料国家重点实验室, 四川 绵阳 621010; 2.西南科技大学 材料与化学学院,四川 绵阳 621010)
(1.State Key Laboratory of Environment-friendly Energy Materials,Southwest University of Science and Technology, Mianyang Sichuan 621010, China; 2.School of Materials and Chemistry, Southwest University of Science and Technology, Mianyang Sichuan 621010, China)
physical chemistry; ammonium perchlorate; polyethyleneimine; PEI; catalytic thermal decomposition; electrostatic self-assembly
DOI: 10.14077/j.issn.1007-7812.202306004
固体推进剂是固体火箭发动机的主要动力来源。不同于传统燃料,固体推进剂通常由氧化剂、燃料和黏结剂等混合组成[1],且具有更高的能量密度。其中,氧化剂一般占固体推进剂总质量的60%~80%[2],所以氧化剂的热分解性能将直接影响固体推进剂的综合性能[3,4],如降低氧化剂的分解温度,可以增加推进剂的燃烧速率,缩短点火时间[5]。常用的固体氧化剂有高氯酸铵(AP)[4]、二硝酰胺铵(ADN)[6]、硝仿肼(HNF)[7]等,而AP以其含氧量高、成本低廉、稳定性好、与推进剂中其他组分相容性良好等优点而被广泛应用[8,9]。但是,AP的分解温度相对较高,其高温分解峰一般为400℃; 低温分解阶段(LTD)与高温分解阶段(HTD)之间的温度跨度过大,温差能达到100℃,导致放热量不集中,不利于推进剂的燃烧[10],所以通常需要加入催化剂来降低AP的分解温度以及增加其分解放热量[11,12]。
AP的分解具有高温分解和低温分解两个阶段。根据质子转移机理,在低温分解阶段,质子从NH+4转移到ClO-4被认为是第一次热分解的原因,这一阶段的分解会产生相应的NH3和HClO4。随后的HClO4分解将生成氧化中间体(ClO-3等),然后可以氧化NH3并生成气态分解产物,如氮氧化物和H2O等[13]。由于仅有部分NH3被氧化还原,未反应的NH3不断覆盖在AP的晶体表面,抑制了AP的进一步分解[14-16]。如果NH3覆盖了表面所有的活化中心(反应中心),则分解过程停止。随着温度的进一步升高(大于350℃),AP的分解进入高温分解阶段。这一阶段脱质子的HClO4将会进一步分解,加速NH3氧化反应,并产生更多的气态分解产物,如N2O、NO、NO2、HNO3、HClO、HCl和H2O等[17]。
过渡金属及其金属氧化物经常被用于AP的催化热分解[18-20],具有制备简单、成本低廉、易接受电子等优点。但是金属催化剂容易发生团聚现象,影响了金属材料的催化性能,限制其在AP催化中的应用。聚乙烯亚胺(PEI)是乙烯亚胺通过聚合作用产生的高分子,其分子链上含有大量的氨基[21,22],不但使PEI具有正电荷,从而可以与带有负电荷的AP发生静电自组装作用; 还可以吸附金属催化剂[23,24],使金属催化剂均匀分布在AP表面,从而更好地发挥催化作用。基于此,本研究以PEI为中间层,以增强AP与金属催化剂的界面作用为目的,制备得到了一系列AP/PEI/M复合材料,并研究其对AP热分解的催化性能。
聚乙烯亚胺(PEI),重均相对分子质量10 000,纯度99%,上海阿拉丁生化科技股份有限公司; 高氯酸铜(II)六水合物(Cu(ClO4)2?6H2O),试剂级,上海阿达玛斯试剂有限公司; 乙醇,分析纯,成都市科隆化工有限公司; 高氯酸铵(AP),纯度99%,上海阿拉丁生化科技股份有限公司。
GeminiSEM 300型扫描电子显微镜,德国ZEISS公司; WCR-1B型差热分析,中国北京北光宏远仪器有限公司; X'Pert Pro型X射线衍射仪,荷兰PANalytical公司; STA449F3-QMS 403型同步热分析-质谱联用仪,德国NETZSCH公司; Nicolet iS50型傅里叶变换红外光谱仪,美国Thermo Fisher Scientific公司; K-Alpha+型X射线光电子能谱,美国Thermo Fisher Scientific公司; Aglient 5110型电感耦合等离子体发射光谱仪,美国Agilent科技有限公司; STA 449 F3型同步热分析仪,德国NETZSCH公司。
称取100mg的PEI溶于50mL容量瓶中,乙醇定容,得到2mg/mL的PEI乙醇溶液备用。称取95mg的AP置于10mL的乙醇溶液中,超声完全溶解后,再缓慢滴加1.5mL的PEI乙醇溶液,搅拌反应过夜。加入2mg的金属盐,继续搅拌反应12h后,室温下溶剂挥发获得样品AP/PEI/M(M=Cu(ClO4)2、Pb(ClO4)2、Fe(ClO4)2、CuCl2、Cu(Ac)2或Cu(NO3)2)。为了进一步对比PEI的界面作用增强对AP热分解行为的影响,在总添加量一致的情况下,只添加金属盐并保持其他制备条件不变,得到样品AP/M。
称取120mg的PEI溶于20mL的乙醇溶液中,超声完全溶解,再加入80mg的Cu(ClO4)2,搅拌反应12h。使用去离子水透析72h后冷冻干燥得到样品PEI/Cu(ClO4)2。
为了探究PEI对金属盐催化性能的影响,使用DTA在10℃/min升温速率下对AP/M和AP/PEI/M(M=Cu(ClO4)2、Pb(ClO4)2、Fe(ClO4)2)的热分解行为进行了测试,结果见图1。
图1 升温速率10℃/min下不同金属盐和PEI/金属盐催化AP热分解的DTA曲线
Fig.1 DTA curves of thermal decomposition of AP catalyzed by different metal salts and PEI/metal salts at the heating rate of 10℃/min
由图1(a)可知,原料AP在245℃左右检测出一个吸热峰,在322.3℃和426.7℃检测出两个放热峰,两个放热峰分别对应AP的低温分解阶段和高温分解阶段。当AP中加入金属盐后,AP/Cu(ClO4)2、AP/Pb(ClO4)2、AP/Fe(ClO4)2的高温分解相比于AP分别提前了67.8、27.7和52.1℃。由图1(b)可知,PEI的引入分别使得AP/PEI/Cu(ClO4)2和AP/PEI/Pb(ClO4)2的高温分解进一步提前了24.4℃和10.4℃,证实PEI的引入能够增强Cu(ClO4)2和Pb(ClO4)2对AP热分解的催化性能。然而,AP/PEI/Fe(ClO4)2的高温分解相较于AP/Fe(ClO4)2提高了22.3℃,并且在170.1℃出现了新的放热峰。这可能是因为PEI的加入使得铁盐催化剂在170.1℃发生了分解并放热,从而降低了Fe(ClO4)2的催化性能。上述讨论表明,AP/PEI/Cu(ClO4)2表现出最低的分解温度,且AP的放热更为集中,证实PEI对铜盐的催化效果具有更强的增强作用。因此,后续研究选择铜盐作为金属盐催化剂。
为了研究PEI对不同铜盐催化性能的影响,在相同的条件下制备了AP/M和AP/PEI/M(M=Cu(Ac)2、Cu(NO3)2和CuCl2),并使用DTA在10℃/min的升温速率下对它们进行了热分解测试,结果见图2。
图2 升温速率10℃/min下不同铜盐和PEI/铜盐催化AP热分解的DTA曲线
Fig.2 DTA curves of thermal decomposition of AP catalyzed by different copper salts and PEI/copper salts at the heating rate of 10℃/min
由图2(a)可知,所有的铜盐对AP都具有较好的催化作用。由图2(b)可知,加入PEI后,AP/PEI/M的高温分解峰温进一步降低,说明PEI的引入能够增强铜盐的催化性能。其中,AP/PEI/Cu(ClO4)2在高温分解阶段表现出最低的峰温以及更为集中的放热行为,证实PEI/Cu(ClO4)2对AP的热分解行为具有更好的催化作用。因此,后续研究选择PEI/Cu(ClO4)2作为AP热分解的催化剂。
为了探究催化剂PEI/Cu(ClO4)2对AP热分解催化效果的影响,使用DTA在10℃/min的升温速率下对不同催化剂含量的AP/PEI/Cu(ClO4)2样品进行了热分解测试,结果见图3。
图3 升温速率10℃/min下不同含量催化剂包覆AP的DTA曲线
Fig.3 DTA curves of AP coated with different contents of catalyst at the heating rate of 10℃/min
由图3可知,催化剂PEI/Cu(ClO4)2的加入并不会影响AP的转晶温度,但会使得AP的低温分解以及高温分解阶段提前。随着PEI/Cu(ClO4)2含量的增加,AP的高温分解峰温逐渐降低。PEI/Cu(ClO4)2的质量分数为5%时,AP的高温分解峰温降至334.5℃并表现出尖锐的放热峰; PEI/Cu(ClO4)2的质量分数为7%时,AP的高温分解峰温反而有所升高。在同等条件下,催化剂的含量越少,推进剂的能量损失越小。因此,后续研究选择PEI/Cu(ClO4)2的质量分数为5%。
为了研究催化剂PEI/Cu(ClO4)2对AP热分解的催化动力学,分别在2、5、10、15、20℃/min的升温速率下对纯AP和AP/PEI/Cu(ClO4)2进行DTA测试,结果见图4。
图4 不同升温速率下AP、AP/Cu(ClO4)2和AP/PEI/Cu(ClO4)2的DTA曲线
Fig.4 DTA curves of AP, AP/Cu(ClO4)2 and AP/PEI/Cu(ClO4)2 at different heating rates
由图4(a)可知,升温速率对AP的转晶温度基本没有影响。但AP的低温分解和高温分解均随着升温速率的增加而向后移动。由图4(b)和(c)可知,催化剂的加入也不会对AP的转晶温度造成影响,只是低温分解和高温分解峰温都有了较大的提前。
为了进一步获得AP和AP/PEI/Cu(ClO4)2的热分解动力学参数,使用式(1)Kissinger-Akahira-Sunose(KAS)法[25]和式(2)Flynn-Wall-Ozawa(FWO)法[26]对样品的分解温度与加热速率之间的关系进行拟合,结果见图5和表1。
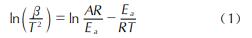
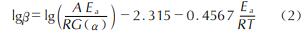
式中:β为加热速率,K/min; T为分解峰的峰温,K; A为指前因子; R为气体常数,8.314kJ/(mol?K); Ea为表观活化能,kJ/mol; G(α)为机理函数; α为分解深度。
Ea/lnA的比值可用来描述反应活性,比值越小反应活性越好[27]。从表1可知,加入Cu(ClO4)2催化剂后,AP/Cu(ClO4)2在高温和低温分解阶段的Ea/lnA值相较于原料AP均降低,证实Cu(ClO4)2能够提高AP热分解的反应活性。加入PEI后,AP/PEI/Cu(ClO4)2在高温和低温分解阶段的Ea/lnA值进一步降低,证实PEI的引入能够增强Cu(ClO4)2对AP热分解的催化性能。
图5 高温分解阶段AP、AP/Cu(ClO4)2和AP/PEI/Cu(ClO4)2的KAS方法和FWO方法的拟合结果
Fig.5 The fitting results of AP, AP/Cu(ClO4)2 and AP/PEI/Cu(ClO4)2 by using the KAS method and FWO method in the HTD stage
表1 AP、AP/Cu(ClO4)2和AP/PEI/Cu(ClO4)2的热分解动力学参数
Table 1 Kinetic parameters of thermal decomposition of AP, AP/Cu(ClO4)2 and AP/PEI/Cu(ClO4)2
为了考察催化剂的加入对AP失重和表观放热量的影响,使用TG-DSC对AP和AP/PEI/Cu(ClO4)样品进行了热分解测试(测试条件:Al2O3坩埚,氮气气氛,升温速率15℃/min),结果见图6和表2。
图6 升温速率15℃/min下AP和AP/PEI/Cu(ClO4)2的TG-DSC曲线
Fig.6 TG-DSC curves of AP and AP/PEI/Cu(ClO4)2 at the heating rate of 15℃/min
从图6和表2可知,AP/PEI/Cu(ClO4)的低温分解峰温提前了29.8℃,高温分解峰温降低了94.2℃,且AP的总表观放热量也从215.39J/g升至728.3J/g。对比TG曲线可以发现,与AP相比,加入催化剂的样品TG曲线上的失重温度明显提前,且AP/PEI/Cu(ClO4)2的TG曲线呈现出更陡的趋势。TG曲线越陡,说明AP/PEI/Cu(ClO4)2的放热更为集中,进而证实了PEI/Cu(ClO4)2对AP具有良好的催化效果。
为了探究PEI/Cu(ClO4)2对AP热分解的催化机理,采用扫描电子显微镜(SEM-EDS-Mapping)对AP/PEI/Cu(ClO4)2的表面形貌和元素分布进行了研究,结果见图7。
图7 AP、AP/PEI/Cu(ClO4)2的SEM及对应的Cu-Mapping
Fig.7 SEM images of AP, AP/PEI/Cu(ClO4)2 and corresponding Cu-Mapping of AP/PEI/Cu(ClO4)2
为了更好地了解PEI/Cu(ClO4)2的加入对AP形貌的影响,在不添加催化剂的情况下,采用相同的制备工艺处理得到原料AP。由图7(a)可知,原料AP的晶体表面较为光滑,存在团聚现象。由图7(b)可知,AP/PEI/Cu(ClO4)2样品表面更为粗糙,团聚更为紧密,这可能是因为PEI/Cu(ClO4)2包覆于AP表面上使得AP/PEI/Cu(ClO4)2样品表面更加粗糙。PEI本身具有黏性,使得AP的团聚现象更为严重。图7(c)和(d)证实了AP/PEI/Cu(ClO4)2样品中Cu元素的存在,且Cu均匀分布在AP粒子的表面。上述结果说明PEI作为中间层不但可以与AP发生自组装包覆,还可以吸附铜金属催化剂于AP表面。
为了探究PEI/Cu(ClO4)2是否成功包覆在AP的表面,采用X射线光电子能谱(XPS)对AP/PEI/Cu(ClO4)2进行了定性分析,结果见图8。从N1s光谱分析,AP只有一个特征峰,402.20eV归属于AP本身的氮元素[28],而AP/PEI/Cu(ClO4)2总共有4个特征峰,402.33eV归属于AP上—NH4的氮元素[28],而401.84、401.40和399.61eV分别属于PEI上面的伯、仲、叔氨基中的氮元素[29-31]。XPS结果进一步证明了PEI/Cu(ClO4)2成功包覆在AP表面。
图8 AP和AP/PEI/Cu(ClO4)2的N1s谱图
Fig.8 N1s spectra of AP andAP/PEI/Cu(ClO4)2
铜及其化合物对AP的热分解具有一定的催化作用。为了探索PEI对Cu离子吸附量的大小,通过ICP-OES对PEI/Cu(ClO4)2中铜元素的含量进行了测试。测得PEI/Cu(ClO4)2中铜元素质量分数为3.61%。为了进一步探究氨基对Cu离子的螯合作用,在透析中使用盐酸溶液代替去离子水,PEI/Cu(ClO4)2中铜的质量分数降至0.10%,表明氨基螯合的Cu离子容易受pH值的影响。
为了排除晶型对AP热分解的影响,对AP和AP/PEI/Cu(ClO4)2粉末进行了XRD测试,结果见图9。测试结果表明,AP/PEI/Cu(ClO4)2的衍射峰位移与纯AP样品基本一致,说明PEI/Cu(ClO4)2包覆不会导致AP的晶型发生转变。但是,包覆后的样品在19.3°、23.8°、34.6°等位置的峰强度发生了变化,这可能是由于PEI/Cu(ClO4)2的引入,其在AP晶体表面上的包覆作用导致峰强度发生变化。
图9 AP和AP/PEI/Cu(ClO4)2的粉末XRD图谱
Fig.9 XRD spectra of AP and AP/PEI/Cu(ClO4)2 powder
为了佐证XRD的数据以及考察包覆前后样品表面官能团的变化,使用红外光谱仪对包覆前后的样品进行了红外光谱表征,结果见图 10。
图 10 AP和AP/PEI/Cu(ClO4)2的红外光谱图
Fig.10 Infrared spectra of AP and AP/PEI/Cu(ClO4)2
从图 10可知,3300cm-1和3150cm-1附近是N—H伸缩振动峰[32],1402cm-1附近是N—H的弯曲振动峰[32],1084、939、626cm-1附近是ClO-4的伸缩振动峰[32]。包覆后,上述特征峰发生了部分位移,这可能是PEI/Cu(ClO4)2与AP的静电相互作用导致官能团的振动峰发生位移,从而也证实了PEI/Cu(ClO4)2对AP的成功包覆。
Zeta电位是能够直观表示物体表面静电荷特征的一种手段。为了验证AP能否与PEI/Cu(ClO4)2成功发生静电自组装反应,使用Zeta电位仪对AP、PEI、AP/PEI和AP/PEI/Cu(ClO4)2进行了Zeta电位的测试,测得其Zeta电位分别为-19.17、9.78、-13.04、-10.89mV。
由于AP本身具有ClO-4,所以其水溶液呈电负性,Zeta电位为-19.17mV; 而PEI本身具有高阳离子性,所以其水溶液呈电正性,Zeta电位为9.78mV; AP/PEI的Zeta电位为-13.04mV,比纯AP高,这是因为PEI的正电荷与AP本身的负电荷相互抵消,从而使得整体的Zeta电位升高,这一现象说明PEI成功附着在AP的表面。同时,AP/PEI/Cu(ClO4)2的Zeta电位是-10.89mV,比AP/PEI高2.15mV,说明PEI成功吸附Cu(ClO4)2,PEI/Cu(ClO4)2成功包覆在AP的表面。上述结果表明PEI/Cu(ClO4)2粘附在AP的表面上,且成功发生了静电自组装反应。
为了探究PEI/Cu(ClO4)2对AP可能的热分解催化机理,使用TG-DSC-MS对AP/PEI/Cu(ClO4)2进行测试(测试条件:Al2O3坩埚,氮气氛,升温速率10℃/min),结果见图 11。
图 11 AP/PEI/Cu(ClO4)2的TG-MS图
Fig.11 TG-MS spectrum of AP/PEI/Cu(ClO4)2
从图 11可知,AP/PEI/Cu(ClO4)2在246.2℃处检测到吸热峰,同时无分子碎片信号检出,证实此吸热峰为AP的转晶吸热峰,不发生AP的分解。随着温度的上升,两个放热峰及其对应的两个失重曲线被检测到,并伴随相应的分子碎片信号。在第一个放热失重阶段(LTD)主要检测到NH+3、OH+、NO+、N2O+、O+2和H2O+等分子碎片信号; 在第二个放热失重阶段(HTD)还检测到37Cl+和35Cl+的分子碎片信号,且NH+3、OH+、NO+、N2O+、O+2和H2O+的信号强度明显大于第一个放热失重阶段,证实AP/PEI/Cu(ClO4)2仍然存在高温和低温两步分解,且在高温阶段的分解更加剧烈。
基于此,PEI/Cu(ClO4)2对AP可能的催化机理见图 12。对于低温分解阶段,PEI/Cu(ClO4)2不但可以促进NH+4与ClO-4间的质子转移,使得分解峰温提前; 而且由于Cu具有良好的电子转移性质,可以促进HClO4生成超氧离子[33-35],进而更高效地与NH3反应,从而产生NH3的氧化产物和HClO4的分解产物的分子碎片信号。随着温度的进一步上升,HClO4分解产生更多的氧化中间体与NH3反应,从而加速了AP的分解,使得高温分解阶段的热流曲线更加尖锐。而PEI的引入增强了AP和铜催化剂之间的界面作用,使金属催化剂更均匀地分布在AP表面,从而更高效地发挥Cu的电子转移效应,表达其对AP热分解的催化作用。
图 12 PEI/Cu(ClO4)2催化AP热分解的示意图
Fig.12 Schematic diagram of PEI/Cu(ClO4)2 catalyzed AP thermal decomposition
(1)采用静电自组装制备了AP/PEI/Cu(ClO4)2包覆样品,DTA测试表明,包覆样品的低温和高温分解峰温分别降低了33.5℃和92.2℃,且Ea/lnA值减小,证实PEI/Cu(ClO4)2对AP的低温和高温分解都具有催化作用。
(2)通过SEM、EDS-Mapping、XRD、红外光谱和Zeta电位等对AP/PEI/Cu(ClO4)2的形貌结构和组成进行了分析,证实PEI/Cu(ClO4)2对AP的静电自组装包覆使得铜金属催化剂均匀分布在AP表面。
(3)通过TG-DSC-MS测试了AP/PEI/Cu(ClO4)2的分解产物,解析了AP/PEI/Cu(ClO4)2的热分解行为,并提出了AP/PEI/Cu(ClO4)2可能的分解催化机理,认为PEI的引入增强了AP和Cu金属催化剂之间的界面作用,使金属催化剂更均匀地分布在AP表面,从而提高Cu金属催化剂对AP热分解的催化作用。